研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
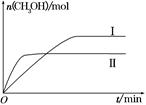
①该反应的平衡常数的表达式为K=________。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”、“等于”或“小于”)。
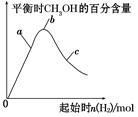
③在下图a、b、c三点中,H2的转化率由高到低的顺序是________(填字母)。
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填序号)。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-28.5 kJ·mol-1
(2)①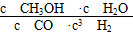 ②大于 ③a、b、c
②大于 ③a、b、c
(3)bc
利用盖斯定律即可写出相应的热化学方程式。分析曲线Ⅰ、Ⅱ可知,两曲线的温度不同,且曲线Ⅰ的温度低于曲线Ⅱ的温度,由于该反应是放热反应,所以KⅠ>KⅡ。H2的起始投入量越少,其平衡转化率越高。在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,所有组分的浓度均增大,正、逆反应速率均加快,平衡正向移动,生成物的物质的量增加,反应物的转化率增大,重新达到平衡时n(H2)/n(CH3OH)减小。
