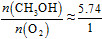问题
选择题
甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH3OH(g) CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g) 2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
A.5.74∶1
B.11.48∶1
C.1∶1
D.2∶1
答案
答案:A
据题意知,应满足第①个反应所吸收的热量与第②个反应所放出的热量相等,则84.2 kJ·mol-1×n(CH3OH)="483.6" kJ·mol-1×n(O2),即