(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置实现上述过程:
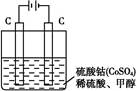
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极反应式: 。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
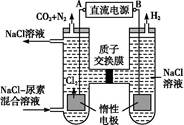
①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g (忽略气体的溶解)。
(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)①Co2+-e-=Co3+
②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
(3) Al-3e-+3HC =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
(4)①B ②2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=CO2+N2+6HCl
③不变 7.2
(1)Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH="-129.0" kJ·mol-1
Ⅰ+Ⅱ得:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)根据反应原理,通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化,则通电时Co2+失电子,阳极的电极反应式为Co2+-e-=Co3+。除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
(3)Al—空气原电池铝作负极,失电子生成铝离子,和碳酸氢钠反应生成氢氧化铝和二氧化碳。负极:Al-3e-+3HC =Al(OH)3↓+3CO2↑。
=Al(OH)3↓+3CO2↑。
(4)①由图可知产生Cl2的电极为阳极,故A为正极,B为负极。②阳极室发生的反应首先为2Cl--2e-=Cl2↑。由产物CO2、N2可知CO(NH2)2在此室被氧化,Cl2被还原,故反应为CO (NH2)2+3Cl2+H2O=CO2+N2+6HCl。③阴极发生2H++2e-=H2↑,同时阳极室HCl电离出的H+通过质子交换膜进入阴极室,从而使阴极室H+浓度保持不变,即pH与电解前相比不变。两极共收集到的气体n(气体)= ="0.6" mol,由:
="0.6" mol,由:
CO(NH2)2~3Cl2~3H2~CO2~N2
60 g 5 mol
m[CO(NH2)2] 0.6 mol
得:m[CO(NH2)2]= ="7.2" g。
="7.2" g。
