研究SO2、CO等大气污染物的处理与利用具有重大意义。
Ⅰ.利用钠碱循环法可脱除烟气中SO2,该法用Na2SO3溶液作为吸收剂,吸收过程pH随n(SO)n(HSO3-)变化关系如下表:
| n(SO32-)n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是 __。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)若某溶液中含3 mol Na2SO3,逐滴滴入一定量稀HCl,恰好使溶液中Cl-与HSO3-物质的量之比为21,则滴入盐酸中n(HCl)为 __mol。
Ⅱ.CO可用于合成甲醇,反应原理为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(4)在容积为2 L的密闭容器中通入0.2 mol CO,0.4 mol H2,达到平衡时,CO转化率为50%,则该温度下的平衡常数为 __,再加入1.0 mol CO后,重新达到平衡,CO的转化率 __(填“填大”“不变”或“减小”);平衡体系中CH3OH的体积分数 __(填“增大”“不变”或“减小”)。
(5)已知CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
H2(g)+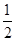 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
有关键能数据如下:(单位:kJ/mol)
| 化学键 | H—H | H—O | C—H | C—O | C=O |
| 键能 | 435 | 463 | 413 | 356 | 745 |
写出甲醇气体完全燃烧生成气态水的热化学方程式: __。
(1)酸 HSO3-电离趋势大于水解趋势
(2)ab
(3)4
(4)100 L2/mol-2 减小 减小
(5)CH3OH(g)+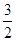 O2(g)=CO2(g)+2H2O(g) ΔH=-536.4 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-536.4 kJ/mol
(1)由表格看出pH随HSO3-的增大而减小,所以HSO3-的电离大于水解,溶液显酸性。(2)溶液呈中性时c(H+)=c(OH-),依据电荷守恒:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),所以a对,c错,由表格知当溶液呈中性时c(HSO3-)>c(SO32-),所以b正确。(3)设加入盐酸x mol,根据反应:H++SO32-=HSO3-,H++HSO3-=H2SO3,可知x=3+(3-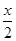 ),解得x=4 mol。(4)由CO的转化率可知平衡时c(CO)=0.05 mol·L-1、c(H2)=0.1 mol·L-1、c(CH3OH)=0.05 mol·L-1,代入K=
),解得x=4 mol。(4)由CO的转化率可知平衡时c(CO)=0.05 mol·L-1、c(H2)=0.1 mol·L-1、c(CH3OH)=0.05 mol·L-1,代入K=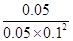 =100;加入CO平衡向减弱这种改变的方向移动,故CO自身的转化率降低,总物质的量增大,故CH3OH体积分数减小。(5)ΔH=反应物的总键能一生成物的总键能,第一个方程式ΔH=3×413 kJ/mol+356 kJ/mol+3×463 kJ/mol-(2×745 kJ/mol+3×435 kJ/mol)=+189 kJ/mol,1 mol甲醇燃烧时总反应为第一个反应+第二个反应×3,则ΔH=-536.4 kJ/mol。
=100;加入CO平衡向减弱这种改变的方向移动,故CO自身的转化率降低,总物质的量增大,故CH3OH体积分数减小。(5)ΔH=反应物的总键能一生成物的总键能,第一个方程式ΔH=3×413 kJ/mol+356 kJ/mol+3×463 kJ/mol-(2×745 kJ/mol+3×435 kJ/mol)=+189 kJ/mol,1 mol甲醇燃烧时总反应为第一个反应+第二个反应×3,则ΔH=-536.4 kJ/mol。
点拨:本题考查离子浓度大小比较,考查考生对离子浓度大小比较的掌握情况。难度中等。
