氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应: C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH =__________ ___。
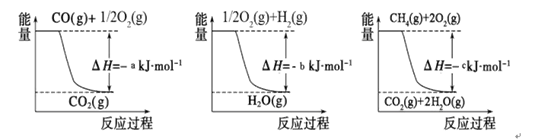
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________.
a.2c1 =3mol/L b.ω1 = ω2 c.2ρ1 = ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
(16分)I.ΔH =(a+3b-c)( 3分)
Ⅱ.(1)c(3分);
(2)t > 5 (2分);
(3)0.2 mol·L-1·min-1(2分,数据1分,单位1分)
(4)c(3分);
(5)K= 4/81(3分)
题目分析:I.由图知CO(g)+1/2O2(g)=CO2(g)△H=-akJ/mol; ①
H2(g)+1/2O2(g)= H2O(g) △H=-bkJ/mol; ②
CH4(g)+2O2(g)= 2H2O(g)+ CO2(g) △H=-ckJ/mol ③;根据盖斯定律得方法②中反应的ΔH =③-①-②×3=-c-(-a)-(-b)×3=(a+3b-c)kJ/mol;
Ⅱ.(1)a、平衡时容器内N2、H2、NH3的浓度之比不一定为1︰3︰2,错误;b、根据化学方程式得3v(N2)正=v(H2)逆 ,错误;c、容器体积不变,一定温度下,随着反应的进行,气体的物质的量在减少,所以容器的压强逐渐减小,当平衡时,压强不再变化,正确;d、根据质量守恒定律,该恒容容器中的气体的密度一直不变,不能判断平衡状态的到达,错误,答案选c。
(2)甲与乙比,反应物的浓度小,所以反应速率慢,达平衡的时间长,则t>5min;
(3)氮气的初始浓度是4mol/L,平衡浓度是3mol/L,所以氮气的浓度减少1mol/L,则乙中氮气的平均反应速率为1mol/L/5min=0.2mol·L-1·min-1
(4)乙与甲比,乙的反应物浓度是甲的2倍,相当于在甲的平衡的基础上又充入3 mol H2、2 mol N2,若平衡不移动,则2c1 =3mol/L,ω1 = ω2,而实际在恒温恒容时增大反应物的浓度平衡正向移动,所以3>2c1,ω2 >ω1 ,ab错误;对于恒容条件下的可逆反应,体系中各物质均是气体,乙中的气体质量是甲中气体质量的2倍,所以乙的密度也是甲的2倍,c正确,答案选c。
(5)根据(3)的计算,消耗氮气1mol/L,消耗氢气3mol/L,则生成氨气2mol/L.该温度下,容器乙中各物质的平衡浓度分别为c(N2)=3mol/L,c(H2)=3mol/L,c(NH3)=2mol/L,所以
K= c(NH3)2/ c(N2)·c(H2)3=4/81(mol/L)-2
