工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1
2SO2(g)+ O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_______(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是 。
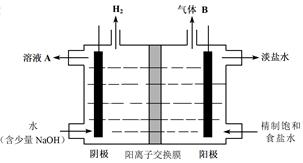
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 。
(1)SO2+H2O H2SO3 2H2SO3+O2==2H2SO4 (2分)
H2SO3 2H2SO3+O2==2H2SO4 (2分)
(2)①NO2(g)+SO2(g)= SO3(g)+NO(g) △H= -41.8 kJ·mol-1 (2分)
② 减小(2分)
(3)①2 (2分)② b c (2分)
①2NaCl +2H2O 2NaOH +H2 ↑ +Cl2 ↑(2分)
2NaOH +H2 ↑ +Cl2 ↑(2分)
②SO2 + OH- =HSO3-(或SO2 + 2OH- =SO32- + H2O)(1分)
③SO2 +Cl2+H2O==4H++SO42-+2Cl- (1分)
题目分析:(1)SO2在烟尘的催化下形成硫酸的反应方程式是SO2+H2O H2SO3 2H2SO3+O2
H2SO3 2H2SO3+O2 2H2SO4。
2H2SO4。
(2)①将已知的后个方程式减去前一个方程式,再除以2得:NO2和SO2反应的热化学方程式为NO2(g)+SO2(g)= SO3(g)+NO(g) △H= -41.8 kJ·mol-1。
②该反应是放热反应,随温度升高,该反应化学平衡常数变化趋势是减小。
(3)①2SO2 + O2 2SO3
2SO3
起始:2.0 1.0 0
变化:2x x 2x
平衡:1.0 0.5 1.0
平衡常数K=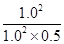 =2.
=2.
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是使平衡正向移动。
a.温度和容器体积不变,充入1.0 mol He ,不改变反应物浓度,平衡不移动;
b.温度和容器体积不变,充入1.0 mol O2,平衡正向移动;
c.在其他条件不变时,减少容器的体积,加压,平衡正向移动;
d.在其他条件不变时,改用高效催化剂,不改变平衡状态;
e.在其他条件不变时,升高体系温度,平衡逆向移动。
(4)①电解饱和食盐水的化学方程式是2NaCl +2H2O 2NaOH +H2 ↑ +Cl2 ↑。
2NaOH +H2 ↑ +Cl2 ↑。
②用NaOH溶液吸收含二氧化硫的废气,可生产SO32-或HSO3-。
③阳极区气体Cl2溶液吸收含二氧化硫的废气,是氧化SO2:SO2 +Cl2+H2O==4H++SO42-+2Cl-。
