2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒。
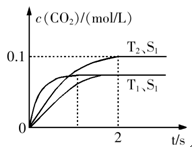
汽车尾气净化的主要原理为:2NO(g)+2CO(g)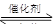 2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
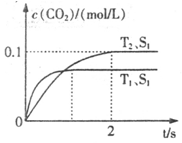
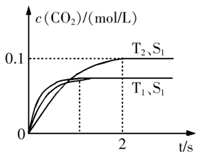
(1)该反应为 反应(填“放热”或“吸热”):在T2温度下,0~2s内的平均反应速率:v(N2)= ;(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0)。
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K= ,平衡时NO的体积分数为 。
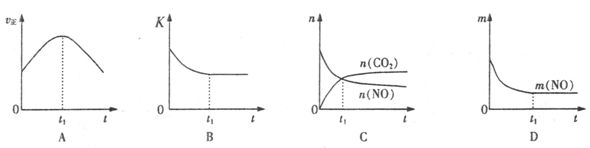
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0kJ • mol-1
2NO2 (g)  N2O4 (g) △H=-56.9kJ • mol-1
N2O4 (g) △H=-56.9kJ • mol-1
H2O(g) = H2O(l) △H=-44.0kJ • mol-1
写出CH4催化还原N2O4 (g)生成N2 (g)、CO2 (g)和H2O(l)的热化学方程式 。
(1)放热 0.025 mol/(L·s) (各2分,共4分)
(2)见图(在T1S1下方,起点不变、终点在虚线后即可,合理均可)(2分)
(3)5000 L/mol (2分) 2.41% (2分)
(4)B D (共2分,少选得1分,错选不得分)
(5)CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g) D H═ —898.1kJ/mol (2分)
题目分析:⑴依据“先拐先平,数值大”的原则,可知:T1>T2,而在T1条件下可知,二氧化碳的含量反而低,可知,升高温度反应逆向移动,因此正向是放热的。化学反应速率等于单位时间内反应物或者生成物浓度的变化量,因此可以确定用二氧化碳表示的化学反应速率就为:0.050 mol/(L·s),再依据化学反应速率之比等于化学计量数之比,可知;用氮气表示的化学反应速率就为:0.025 mol/(L·s)。⑵增大表面积,只是增大反应速率,并不影响二氧化碳的含量,因此,只是反应达到平衡的时间延长,并不影响二氧化碳的量。
⑶ 2NO(g) + 2CO(g) 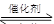 2CO2 + N2
2CO2 + N2
起始浓度:10-3mol/L 3.6×10-3mol/L 0 0
转化浓度:9.0×10-4mol/L 9.0×10-4mol/L 9.0×10-4mol/L 4.5×10-4mol/L
平衡浓度:10-4mol/L 2.7×10-3mol/L 9.0×10-4mol/L 4.5×10-4mol/L
因此平衡常数: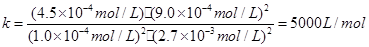
根椐,平衡时体积比等于物质的量之比,等于浓度之比,所以平衡时NO的体积分数为:
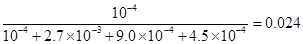

⑷A图中正反应速率反应开始后是减小的,错误;B图中表示的是化学平衡常数随时间的变化,因为是绝热的,而反应又是放热的,所以随着反应的进行,放出的热量散不出去,使反应逆向移动,使得平衡常数减小,但在某一个时刻达到平衡状态。正确;C图中在t1后各自的物质的量还在变化,则不是平衡状态,错误;D图中一氧化氮的质量在t1时刻质量不变,一定是一个平衡状态。正确。
⑸ ①CH4(g)+2NO2(g) = N2 (g)+CO2 (g)+2H2O(g) △H=-867.0kJ • mol-1
②2NO2 (g)  N2O4 (g) △H=-56.9kJ • mol-1
N2O4 (g) △H=-56.9kJ • mol-1
③H2O(g) = H2O(l) △H=-44.0kJ • mol-1
①-②+③×2:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g) D H═ —898.1kJ/mol
