已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和726.5 kJ·mol-1。请回答下列问题。
(1)用太阳能分解5 mol液态水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 。
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为 。
理想状态下,该燃料电池消耗2 mol甲醇所能产生的最大电能为1 404.2 kJ,则该燃料电池的理论效率为 。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
(1)1 429
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-443.5 kJ·mol-1
(3)O2+4e-+4H+=2H2O 96.6%
(1)根据能量守恒定律可知分解5 mol液态水消耗的能量与生成5 mol液态水放出的能量相等,285.8 kJ·mol-1×5 mol=1 429 kJ。
(2)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1 ①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 453.0 kJ·mol-1 ②
根据盖斯定律(②-①)÷2得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-443.5 kJ·mol-1。
(3)甲醇燃料电池的正极反应物为O2,酸性条件下生成H2O:O2+4e-+4H+=2H2O。2 mol甲醇完全燃烧放出的热量为1 453.0 kJ,故该电池的理论效率为1 404.2 kJ÷1 453.0 kJ×100%=96.6%。

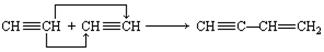
 它是由不饱和烃乙的两
它是由不饱和烃乙的两