苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
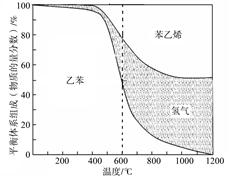
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g)+ C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
(1)①25% ; 50% (共4分,各2分) ②33% (2分)
③(共4分) C6 H5- CH2 CH3 (g)  C6 H5- CH=CH2 (g) + H2(g)
C6 H5- CH=CH2 (g) + H2(g)
起始浓度/( mol•L-1) : a/V 0 0
变化浓度/( mol•L-1) : a/3V a/3V a/3V
平衡浓度/( mol•L-1) : 2a/3V a/3V a/3V(2分)
K =( a/3V• a/3V)/ (2a/3V) = a/6V (2分)
(2)> (2分) ;
(3)> (2分) ;
(4)ΔH1+ΔH2+ΔH3 (2分)
题目分析:(1)①从图中可判断乙苯的物质的量分数是50%,设消耗乙苯xmol,则生成苯乙烯和氢气各xmol,所以余(a-x)mol乙苯,则(a-x)mol/(a-x)mol+2xmol=0.5,解得x=1/3amol,所以氢气的物质的量分数是1/3a/(a+1/3a)×100%=25%;
②乙苯的平衡转化率为1/3a÷a×100%=33%;
③平衡常数大等于平衡时生成物的浓度幂之积除以反应物的浓度幂之积,首先计算三种物质的平衡浓度,由①分析得平衡时乙苯的物质的量是a-1/3a=2/3a,苯乙烯、氢气的物质的量都是1/3a,容器体积为VL,所以K=( a/3V• a/3V)/ (2a/3V) = a/6V,计算过程如下(三段式法)
C6 H5- CH2 CH3 (g)  C6 H5- CH=CH2 (g) + H2(g)
C6 H5- CH=CH2 (g) + H2(g)
起始浓度/( mol•L-1) : a/V 0 0
变化浓度/( mol•L-1) : a/3V a/3V a/3V
平衡浓度/( mol•L-1) : 2a/3V a/3V a/3V
K =( a/3V• a/3V)/ (2a/3V) = a/6V
(2)杨浦图判断,温度升高乙苯的物质的量分数减小,说明升温平衡正向移动,所以正向是吸热反应△H1>0;
(3)温度不变,加入稀释剂水蒸气并保持体系总压为101.3kPa,则容器体积增大,相当于给反应体系降低压强,平衡正向移动,所以再次平衡时乙苯的转化率>30%;
(4)根据盖斯定律,将已知三个热化学方程式相加即得所求方程式,则所求热效应也等于三式的热效应相加,所以ΔH=ΔH1+ΔH2+ΔH3。
