已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。(2)反应①为 (选填“吸热”或“放热”)反应。(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。A.缩小反应器体积 B.通入CO2
C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
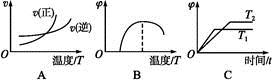
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
(1)1 mol·L-1 (2)吸热 (3)BC (4)A
(5)2(a+b) kJ·mol-1(6)2Fe(s)+3/2O2(g) Fe2O3(s)ΔH="(3b-c)" kJ·mol-1
Fe2O3(s)ΔH="(3b-c)" kJ·mol-1
(1)(2)依据反应①,可写出该反应的化学平衡常数表达式K=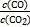 ,从表中数据观察到:K值随温度升高而增大,说明正反应为吸热反应。在500 ℃时,假设CO2转化了x mol·L-1,达到平衡状态时,有下式成立:K=
,从表中数据观察到:K值随温度升高而增大,说明正反应为吸热反应。在500 ℃时,假设CO2转化了x mol·L-1,达到平衡状态时,有下式成立:K= =1.00,解得x=1,即平衡时CO的浓度为1 mol·L-1。
=1.00,解得x=1,即平衡时CO的浓度为1 mol·L-1。
(3)中,700 ℃时反应①达到平衡,要使该平衡向右移动,可以升高体系温度、增大反应物浓度(通入CO2),注意不要错选选项E,因为反应物Fe是固体,改变固体或纯液体的量对平衡无影响。
(4)中,图像A是温度改变对反应速率的影响,由于反应①的正反应是吸热反应,所以升高温度,正逆反应速率均增大,但正反应速率增大的幅度大,故A正确。图像B是温度改变对混合物中CO含量的影响,温度较低时反应不进行,随着温度升高混合物中CO的含量逐渐增大,不会减小,故B错误。图像C中T1>T2,温度升高平衡向右移动,则CO的含量高,故C错误。
(5)中,由反应①和②,进行如下处理:①+②,得到:
Fe(s)+O2(g) FeO(s) ΔH="(a+b)" kJ·mol-1,
FeO(s) ΔH="(a+b)" kJ·mol-1,
故反应2Fe(s)+O2(g) 2FeO(s)的ΔH="2(a+b)" kJ·mol-1。
2FeO(s)的ΔH="2(a+b)" kJ·mol-1。
(6)中,由反应③和②,进行如下处理:③-②×3,得到:
Fe2O3(s) 2Fe(s)+O2(g) ΔH="(c-3b)" kJ·mol-1,
2Fe(s)+O2(g) ΔH="(c-3b)" kJ·mol-1,
所以Fe固体被O2氧化得到Fe2O3固体的热化学方程式为:
2Fe(s)+O2(g) Fe2O3(s) ΔH="(3b-c)" kJ·mol-1。
Fe2O3(s) ΔH="(3b-c)" kJ·mol-1。

 面副沟多
面副沟多