平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。

①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表 示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5mol•L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol•L-1的HCN溶液的pH=_________。
(4)对于0.1mol•L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
(1) (ΔH1-ΔH2) /2 ;(K1/K2)1/2(只要表示方式正确均给分)
(2)①加压,加催化剂(2分,少一种扣1分,错一种倒扣1分);
②9/14(3分,有单位的扣1分);0.012 mol•L-1•min-1(单位错误或不写单位均扣1分。)
(3)3;
(4)c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)(;减小(1分),增大(1分)(没有按要求填写的不得分,如“增加”等)。
题目分析:(1)第一个反应计量数同除以2,第二个反应的逆反应计量数同除以2,相加可得要求的反应,根据盖斯定律,∆H=-1/2∆H1—1/2∆H2= (ΔH1-ΔH2) /2 ;分步反应加和,平衡常数为相乘,系数变化的倍数为指数,则K=(K1/K2)1/2
(2)①反应II反应速率加快,但平衡时A的物质的量不变,说明平衡不移动,因为该反应气体的系数不变,所以可能改变的条件是:加压,加催化剂
②根据“三段式”进行计算:A(g)+B(g)  C(g)+D(g)
C(g)+D(g)
初始浓度(mol•L‾1) 1 2 0 0
初始浓度(mol•L‾1) 0.6 0.6 0.6 0.6
初始浓度(mol•L‾1) 0.4 1.4 0.6 0.6
平衡常数=0.6mol/L×0.6mol/L÷(0.4mol/L×1.4mol•L‾1)= 9/14;
A的反应速率="0.6" mol/L÷40min=0.012 mol•L-1•min-1
(3)HCN的电离方程式为:HCN 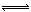 H++ CN-,因为水的电离可不计,所以H+浓度等于CN-浓度,则电离平衡常数K a=c2(H+)÷0.1mol•L‾1=10-5mol•L-1,解得c(H+)=10-3mol•L-1,pH=—lgc(H+)=3。
H++ CN-,因为水的电离可不计,所以H+浓度等于CN-浓度,则电离平衡常数K a=c2(H+)÷0.1mol•L‾1=10-5mol•L-1,解得c(H+)=10-3mol•L-1,pH=—lgc(H+)=3。
(4)Na2CO3为弱酸强碱盐,CO32‾发生水解反应,第一步反应为:CO32‾+H2O 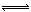 HCO3‾+OH‾,所以离子浓度由大到小的顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);向该溶液中加水稀释的过程中,溶液的体积逐渐变大,所以c(H2CO3)逐渐减小;加水稀释,水解平衡向右移动,所以c(H2CO3)/ c(CO32-)逐渐增大。
HCO3‾+OH‾,所以离子浓度由大到小的顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);向该溶液中加水稀释的过程中,溶液的体积逐渐变大,所以c(H2CO3)逐渐减小;加水稀释,水解平衡向右移动,所以c(H2CO3)/ c(CO32-)逐渐增大。

