2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
(1)已知:① N2(g) + O2(g)=2NO(g) △H=+179.5 kJ/mol
②2NO(g) + O2(g)=2NO2(g) △H=-112.3 kJ/mol
③2NO(g) +2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
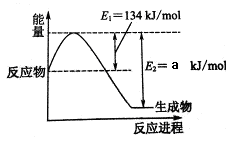
下图是在101kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化的示意图。则a= 。
(2)将不同物质的量的H2O(g)和CO分别通入体积为2L的恒容密闭容器中,进行反应:
H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| 1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验组1中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、 1mol CO、 1 mol CO2和 x molH2,若要使反应在开始时正向进行,则x应满足的条件是 。
③若a=2,b=1,则达平衡时实验组2中H2O(g)和实验组3中CO的转化率的关系为α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(14分)(1)368(3分)(2)①0.16mol/(L·min) (2分) 8/3或2.67 (2分)减少 (2分) ②0≤x<16/3 (3分) ③ =(2分)
题目分析:(1)抑制① N2(g) + O2(g)=2NO(g) △H=+179.5 kJ/mol、②2NO(g) + O2(g)=2NO2(g) △H=-112.3 kJ/mol、③2NO(g) +2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol,则根据盖斯定律可知(①-②+③)÷2即得到反应NO2(g)+CO(g)=NO(g) +CO2(g) △H=-234kJ/mol。则根据图像可知134kJ/mol-a kJ/mol=-234kJ/mol,解得a=368。
(2)①根据表中数据可知平衡时生成氢气的物质的量是1.6mol,则根据方程式可知消耗CO2的物质的量是1.6mol,其浓度是0.8mol/L,则CO2表示的反应速率为0.8mol/L÷5min=0.16mol/(L·min)。
② H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 1mol/L 2mol/L 0 0
转化浓度 0.8mol/L 0.8mol/l 0.8mol/l 0.8mol/l
平衡浓度 0.2mol/L 1.2mol/L 0.8mol/l 0.8mol/l
所以平衡常数K=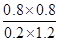 =2.67
=2.67
根据表中1、2数据可知,实验1中CO的转化率为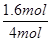 ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为 ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,因此平衡常数减小;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,因此平衡常数减小;
②若要使反应在开始时正向进行,则 <2.67,解得x<16/3,因此x的取值范围是0≤x<16/3。
<2.67,解得x<16/3,因此x的取值范围是0≤x<16/3。
②实验2条件下平衡常数,需要列式计算平衡浓度
H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
则K=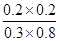 =0.17
=0.17
若a=2,b=1,则
H2O(g)+CO(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 1 0.5 0 0
转化浓度 x x x x
平衡浓度 1-x 0.5-x x x
则 =0.17
=0.17
解得x=0.2
所以在这两种情况下实验组2中H2O(g)和实验组3中CO的转化率均是 ×100%=40%。
×100%=40%。
