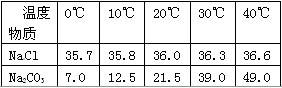
我国某地区有一种“冬天捞碱,夏天晒盐”的传统。这里的“碱”是指Na2CO3,“盐”是指NaCl。这样捞得的“碱”中会含有少量NaCl。下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
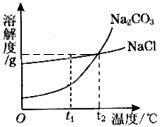
(1)①t1℃时,NaCl的溶解度________Na2CO3的溶解度。(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而_______(填“增大”“减小”或“不变”) 。“捞碱”后剩余的溶液一定是Na2CO3的_______(填“饱和”或“不饱和”)溶液。
③“夏天晒盐”是利用________(填序号)的方法,使NaCl晶体析出。
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据上表分析:
①20℃时,向50克水中加入20克氯化钠固体,充分搅拌,所得的溶液溶质质量分数为________,(最后结果保留一位小数)若使其中的氯化钠完全溶解,所采取的最有效的措施是________________。
②下列几种说法中,正确的是______。
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各100g的氯化钠与碳酸钠的饱和溶液,从30℃降至0℃,析出晶体的质量相等
C.t2对应的温度在20℃--30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式
(1)①>;②减小;饱和;③A
(2)①26.5%;加水;②ACD
