将6 g的铁粉加入200 mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL0.5mol /LFeSO4溶液和5.2 g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
解析:溶液中含有Fe2+:0.5mol/L ×0.2L=0. 1mol< 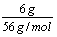
∴6g铁粉过量
设反应消耗铁的物质的量为x,生成铜的物质的量为y
Fe + Fe2 (SO4)3===3FeSO4 Fe + CuSO4===FeSO4 + Cu
1mol 1mol 3mol 1mol 1mol 1mol 1mol
xmol xmol 3xmol ymol ymol ymol ymol
可得: 3x+y=0. 1mol
6g-56x+8y=5.2g
解得x=0.02mol,y=0.04 mol
故得:生成铜质量为0.04 mol×64g/ mol=2.56g
原溶液中Fe2(SO4)3物质的量浓度为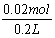 =0.1mol/L
=0.1mol/L
