问题
计算题
将8.8gFeS固体置于200mL2.0mol/L的盐酸中,以制取H2S气体反应完全后,若溶液中H2S的物质的量浓度为0.1mol/L,假设溶液的体积不变,试计算:
(1)收集到H2S气体的体积为_______________(标准状况)
(2)溶液中Fe2+和H+的物质的量浓度。
答案
(1)1.792L
(2)解:FeS + 2HCl = FeCl2 + H2S ↑
88g 2mol
8.8g 0.21L×2.0mol/L
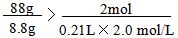
所以盐酸过量
n(Fe2+) = n (FeCl2)= n (FeS) = 8.8g ÷ 88g/mol =0.10mol
c(Fe2+) = 0.10mol ÷ 0.20L =0.50 mol/L
n(H+ ) = n (HCl )总 -n (HCl )反应
= n (HCl )总 -2n (FeCl2 )= 0.21L×2.0 mol/L-2× 0.10mol =0.20mol
c(H+) = 0.20mol ÷ 0.20L = 1.0mol/L
答:溶液中Fe2+和H+的物质的量浓度分别为0.50mol/L和1.0mol/L
