向300mLKOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24 L(标准状况下),得到11.9g的白色固体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
(1)四种①KOH、K2CO3 ②K2CO3 ③K2CO3、KHCO3 ④KHCO3
(2)解:2KOH+CO2 === K2CO3+H2O
22.4 138
2.24 x=13.8
KOH+CO2=== KHCO3
22.4 100
2.24 x=10.0
从上面两方程知:生成的固体全部是K2CO3时应该是13.8 g,若生成的固体全部是KHCO3时应该是
10.0 g,现生成的固体为11.9g,所以它是K2CO3和KHCO3的混合物。
依碳原子守恒的要求,K2CO3和KHCO3总共是: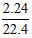 =0.100 mol
=0.100 mol
若K2CO3为a mol,则KHCO3为(0.100-a)mol
则得方程138a+100(0.100-a)=11.9;a=0.050 mol
即K2CO3和KHCO3各为0.050 mol
K2CO3为:138g·mol-1×0.05mol=6.9g
KHCO3为:100 g·mol-1×0.050mol=5.0g
依K+守恒的要求,设KOH溶液浓度为c则:0.300Lc=0.050mol×2+0.050mol
c=0.50mol·L-1
