问题
选择题
根据碘与氢气反应的热化学方程式:
H2(g)+I2(g)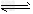 2HI(g)ΔH=–26.48kJ/mol①
2HI(g)ΔH=–26.48kJ/mol①
H2(g)+I2(s)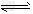 2HI(g)ΔH=+9.48kJ/mol ②
2HI(g)ΔH=+9.48kJ/mol ②
下列判断正确的是[ ]
A.254g I2(g)中通入2gH2(g),反应放热26.48kJ
B.反应②的反应物总能量比反应①的反应物总能量低
C.反应①是放热反应,说明该反应在常温下很容易发生
D.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
答案
答案:B
