一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:
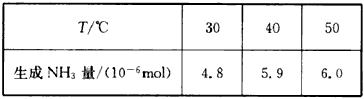
N2+3H2O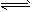 2NH3+3/2O2。进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3h)
2NH3+3/2O2。进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3h)
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为____mol/min。
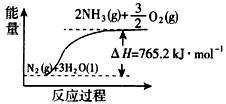
(2)该反应过程与能量关系可用下图表示,完成反应的热化学方程式:____________________。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议_____________________。
(4)工业合成氨的反应为N2(g)+3H2(g)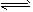 2NH3(g)。设在容积为2.0L的密闭容器中充入0. 80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
2NH3(g)。设在容积为2.0L的密闭容器中充入0. 80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
①该条件下反应2NH3(g)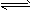 N2(g)+3H2(g)的平衡常数为________。
N2(g)+3H2(g)的平衡常数为________。
②相同条件下,在另一相同容器中充入amol N2(g)和bmol H2(g),达到平衡时,测得容器中NH3为0.8mol,H2为2.0mol,则a=____,b=_____。
(1)2.5×10-8
(2)N2+3H2O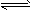 2NH3(g)+O2(g) △H=-765.2 kJ/mol
2NH3(g)+O2(g) △H=-765.2 kJ/mol
(3)升高温度、加压、不断移出生成物脱离反应体系(合理均可)
(4)①0.9375;②0.7;3.2
