问题
计算题
在标准状况下进行下列实验:甲、乙、丙各取 0.3 L同浓度的盐酸,加入不同质量的同一镁铝合金粉末,有关数据如下:
甲:合金质量0. 51 g,生成气体体积0.56L;
乙:合金质量0. 765 g,生成气体体积0.672L;
丙:合金质量0. 918 g,生成气体体积0.672L。
求:合金中镁铝的物质的量之比。
答案
解:(1)分析甲、乙、丙三组实验的数据记录:加入合金的质量:m(甲)<m(乙)<m(丙),生成气体的体积:v(甲)v(乙)= v(丙),由于盐酸的体积相同、浓度相同,因此,丙组实验中盐酸不足,甲组实验中盐酸过量。比较甲、乙两组数据:m(甲): m(乙)=1:1.5,V(甲):V(乙)=1:1:2,则乙组实验中盐酸是不足的。盐酸全部反应。
(2)甲组实验中,镁、铝合金完全参加反应,依据合金的质量和产生H2的体积,可以计算合金中镁、铝的物质的量。
设:合金中镁、铝的物质的量分别为x、y。
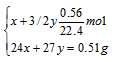
x=y=0. 01mol 则;镁、铝的物质的量之比为1:1。
