在400℃、101kPa时,NO2(g)+CO(g)⇌NO(g)+CO2(g)反应过程的能量变化如图所示.
(1)该反应是______(填“吸热”或“放热”)反应.
(2)该反应的热化学方程式为______.
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是______.
a.浓度 b.压强 c.温度 d.催化剂.
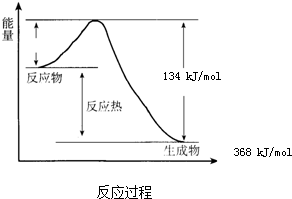
(1)因反应物的能量高于生成物的能量时,反应是放热反应,故答案为:放热;
(2)由图知没反应放出的热量为368KJ•mol-1-134KJ•mol-1=234KJ•mol-1,且该反应为放热反应,热化学方程式为NO2(g)+CO(g)⇌NO(g)+CO2(g)△H=-234KJ•mol-1,
故答案为:NO2(g)+CO(g)⇌NO(g)+CO2(g)△H=-234KJ•mol-1;
(3)催化剂能降低活化能,加快反应速率,故答案为:d.
