以黄铁矿为原料生产硫酸,生产过程中吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
(1)SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收
Br2的离子方程式是____________________。
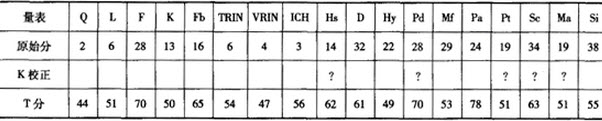
(2)为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入100. 00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。(部分测定结果如下表)
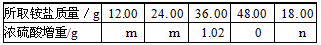
计算(要求写出过程):
①所用NaOH溶液的物质的量浓度。
②该铵盐中氮元素的质量分数是多少?
(1)SO2+Br2+2H2O=4H++2Br-+SO42-
(2)①由12.00 g和24.00 g时浓硫酸增加的质量相同,说明铵盐有酸式盐存在,设氢氧化钠的物质的量浓度为c mol/L,12.00 g铵盐中有x mol的(NH4)2SO4和ymol的NH4HSO4,则132x+115y =12.00 ①
12.00 g时铵盐不足,由N守恒知n(NH3) =2x +y,24. 00 g时铵盐已经过量,(NH4)2SO4为2x mol,
NH4HSO4为2y mol,则氢氧化钠先和HSO4-反应,
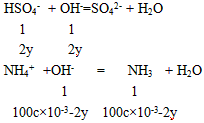
由于12.00 g和24.00 g铵盐产生的氨气一样多,n(NH3)=2x+y=100c×l0-3-2y ②
36.00 g时铵盐过量,(NH4)2SO4为 3x mol, NH4HSO4为3y mol,则n(NH3) =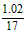 mol = 0. 06 mol 。
mol = 0. 06 mol 。
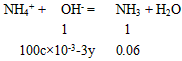
所以100c×10-3-3y =0.06 ③
联立①②③解得x=0.03,y=0.07,c=2.7。
②氮的质量百分含量=(2x+y)×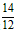 ×100% =(0.06+0. 07)×
×100% =(0.06+0. 07)×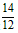 ×100% = 15.17% 。
×100% = 15.17% 。