问题
计算题
将10 mL充满NO2和O2的混合气体的试管倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气中NO2和O2各多少毫升。
答案
解:剩余2 mL气体可能是NO或O2,分两种情况讨论:
(1)剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O=4HNO3。剩余的NO2又与水作用,最终有2mL NO产生。由反应3NO2+H2O=2HNO3+NO得剩余的NO2体积为2mL×3=6mL。则原有O2体积为(10mL-6mL)×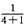 =0.8 mL,NO2体积为10 mL-0.8 mL=9.2 mL。
=0.8 mL,NO2体积为10 mL-0.8 mL=9.2 mL。
(2)剩余的是O2,则有10 mL-2 mL=8 mL是NO2和O2的混合气体按反应:4NO2+O2+2H2O=4HNO3进行。所以NO2的体积为8 mL×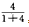 =6.4 mL,O2体积为10 mL-6. 4 mL=3. 6 mL。
=6.4 mL,O2体积为10 mL-6. 4 mL=3. 6 mL。
答:若剩余的是NO,则NO2和O2的体积分别为9.2 mL和 0.8 mL;若剩余的是O2,则NO2和O2的体积分别为6.4 mL和3.6 mL。
