在500 mL CuSO4和Fe2(SO4)3的混合溶液中加入 21.7 g铁粉,待反应完全后,得到16.8 g残留固体。 在滤液中加入400 mL 4 mol/L的BaCl2溶液,恰好使溶液中的SO42-完全沉淀。求原混合液中CuSO4 和Fe2(SO4)3的物质的量浓度。
本题的解答关键是必须先并清16.8 g残留固体的成分,然后根据有关反应的化学方程式进行计算。
n(SO42-)=n(BaCl2)=4mol/L×0.4L=1.6mol
若原混合液中溶质全部是CuSO4,
由Fe+ CuSO4=FeSO4+Cu知,需Fe的质量为:1.6× 56= 89.6 g。
若原混合液中溶质全部是Fe2(SO4)3,
由Fe+ Fe2(SO4)3=3FeSO4知需Fe的质量为: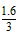 ×56= 29.9 g。
×56= 29.9 g。
因而实际需Fe的质量应介于29.9 g~89.6 g之间。
现加入的Fe为21.7 g,所以Fe的量不足,16.8 g全部是Cu。
设原混合物中Fe2(SO4)3为xmol,CuSO4为ymol。
因为氧化性Fe3+> Cu2+.故Fe先与Fe2(SO4)3反应有
Fe+ Fe2(SO4)3=3FeSO4
x x
Fe + CuSO4 =FeSO4 + Cu
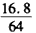
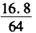
依题意有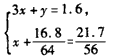 解得x=0. 125,y=1. 225 。
解得x=0. 125,y=1. 225 。
所以c[Fe2(SO4)3]=0.25mol/L,c(CuSO4)=2.45 mol/L。
