取50.0mL K2CO3和K2SO4的混合溶液,加入过量BaCl2溶液后得到12.18g白色沉淀,用过量稀硝酸处理后沉淀量减少到2.33g,并有气体放出。试计算:(请写出计算过程)
(1) 原混合溶液中K2CO3和K2SO4的物质的量浓度。
(2) 产生的气体在标准状况下的体积。
(1)CO32-+ Ba2+ == BaCO3↓ SO42- + Ba2+ == BaSO4↓ BaCO3 + 2H+ == Ba2+ + H2O + CO2↑
由分析知:BaSO4沉淀的质量为2.33g
故:n(BaSO4) =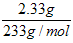 = 0.01mol
= 0.01mol
n(K2SO4) = n(BaSO4) = 0.01mol
C(K2SO4) =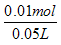 = 0.2mol/L
= 0.2mol/L
12.18g白色沉淀为BaSO4和BaCO3的混合物故:
m(BaCO3) = (12.18 - 2.33 )g = 9.85g
n(BaCO3) =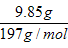 = 0.05mol
= 0.05mol
n(K2CO3) = n(BaCO3) =0.05mol
C(K2CO3) = 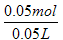 = 1mol/L
= 1mol/L
∴ K2CO3和K2SO4的物质的量浓度分别为:1mol/L、0.2mol/L
(2) n(CO2) = n((BaCO3) = 0.05mol
v(CO2) = 0.05mol × 22.4L/mol = 1.12L