问题
计算题
用8.7 g MnO2和10 mol/L的盐酸120 mL反应制取Cl2。
(1)在标准状况下可生成多少升氯气?
(2)若把反应后的剩余溶液稀释成1L后,取出20 mL(不考虑HCl损失),在这20 mL溶液中加入足量AgNO3溶液,可得AgCl多少克?
答案
(1)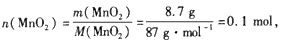
n( HCl)=10 mol/L×0.12L=1.2mol,
MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4
0.1mol 1.2 mol
盐酸过量,依MnO2的量来计算。
n(Cl2)=n(MnO2)= 0.1 mol,
故V(Cl2)=0.1 mol×22.4 L.mol-1=2. 24 L。
(2)由(1)可知n(Cl2)=0.1 mol,根据氯元素守恒,有:
n(Cl-)=n(HCl)-2n(Cl2)=1.2mol -2×0.1mol=1 mol。
在20 mL溶液中,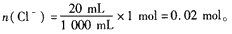
依 Cl-~AgCl,有:n(AgCl)=n(Cl-)=0. 02 mol。
故m( AgCl) = 0. 02 mol×143. 5g.mol-1=2. 87 g。
