问题
计算题
有一定质量的Zn与100 mL 18.5 mol·L-1的浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A
33.6 L,将反应后的溶液稀释到1 L,测得溶液中H+的浓度 为0.1 mol·L-1。求气体A中各组分的体积比。
答案
反应后溶液为1L,H+的浓度为0.1 mol·L-1,则 n(H+) =0.1 mol·L-1×1 L =0.1 mol,
故反应后溶液中剩余硫酸0.05 mol。由于浓硫酸与Zn反应过程中有水生成,溶液变稀,故有H2、SO2两种气体产生。
设SO2 .H2的物质的量分别为 x、y,则:
Zn+H2SO4=ZnSO4+ H2↑
y y
Zn+2H2SO4 (浓)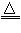 ZnSO4 +SO2↑+2H2O
ZnSO4 +SO2↑+2H2O
2x x
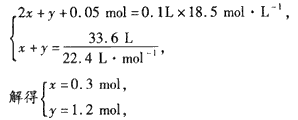
所以A气体中V(SO2):V(H2)=0.3 mol: 1.2 mol=1:4。
