如图是A、B、C三种物质的溶解度曲线,据图回答:
①P点表示______
②温度在t1到t2之间时,三种物质溶解度由大到小的顺序为______
③t3℃时B的饱和溶液结晶应采取______结晶的方法.
④Ca(OH)2的溶解度随温度的变化与图中物质______相似.
⑤将t3℃时,A、B、C的饱和溶液降温t1℃,三种溶液中溶质的质量分数的大小为______.
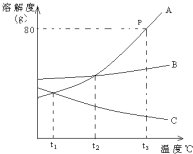
①溶解度曲线上的点表示某一温度时该物质的溶解度,所以P点表示在t3℃时A的溶解度是80g;
②温度在t1℃到t2℃之间溶解度曲线在上边的就大,所以溶解度曲线由大到小的顺序是B>A>C;
③如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.因为B的溶解度随温度变化不大,所以用蒸发溶剂的方法析出晶体;
④因为氢氧化钙的溶解度随温度的升高而减小,所以C物质属于氢氧化钙;
⑤饱和溶液的质量分数计算:
×100%,所以饱和溶液质量分数与溶解度有关,由于A和B降温后溶解度都减小,会析出晶体,仍然饱和,因为t1℃B的溶解度大于A物质的溶解度,所以降温后B的溶质质量分数大于A的,由于C降温后溶解度变大变为不饱和,所以溶质质量分数不变,又因为t1℃A的溶解度大于t3℃时C的溶解度,所以降温后A的溶质质量分数比C的溶质质量分数大,所以三种溶液中溶质的质量分数的大小为:B>A>C.溶解度 100g+溶解度
故答案为:①在t3℃时A的溶解度是80g;②B>A>C;③蒸发;④C;⑤B>A>C.
