钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生
40.32 L(标准状况下)氮气,至少需要叠氮化钠______g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
②计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。

上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
(1)78
(2)①c(OH-)=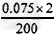 ×1000=0.75(mol/L)
×1000=0.75(mol/L)
②设上述合金中含amolNa、bmolK,
a+b=0.75×2 23a+39b=5.05 a=0.050mol b=0.10mol,该钠-钾合金化学式为NaK2
(3)溶液含NaOH,NaOH与CO2反应生成的Na2CO3:15-1/2×24=3(mol)
112LCO2的物质的量:112/22.4=5(mol)
n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5
(4)由NaCl质量推算,氢氧化钠样品摩尔质量为:
M1(NaOH)= 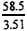 ×2.40=40g/mol
×2.40=40g/mol
M2(NaOH)= 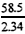 ×2.32=58g/mol
×2.32=58g/mol
M2(NaOH)= 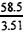 ×3.48=58g/mol
×3.48=58g/mol
结论:实验①所取氢氧化钠样品是NaOH;实验②和③所取氢氧化钠样品应该是NaOH·H2O
