问题
填空题
已知化学反应N2+3H2====2NH3的能量变化如图所示。

(1)1 mol N 和3 mol H 生成1 mol NH3(g)是_________________能量的过程(填“吸收”或“释放”)。
(2)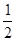 N2(g)+
N2(g)+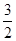 H2(g)====NH3(g) ΔH=_________________。
H2(g)====NH3(g) ΔH=_________________。
(3)N2(g)和H2(g)生成NH3(l)的热化学方程式____________________。
答案
(1)释放
(2)(a-b) kJ·mol-1
(3)N2(g)+3H2(g)====2NH3(l) ΔH="2(a-b-c)" kJ·mol-1
(1)从图示知1 mol N 和3 mol H 具有的总能量比1 mol NH3(g)具有的能量高,故1 mol N 和3 mol H 生成1 mol NH3(g)是释放能量的过程。
(2)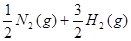 ====NH3(g)的反应热为(a-b) kJ·mol-1。
====NH3(g)的反应热为(a-b) kJ·mol-1。
(3)N2(g)和H2(g)生成2 mol NH3(l)的反应热为2(a-b-c) kJ·mol-1,根据各物质的聚集状态及反应热,即可写出所求的热化学方程式。
