问题
计算题
向铜片中加入某浓度的硫酸120 mL,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500 mL,再加入足量铁粉,使之充分反应收集到标准状况下氢气2.24 L,过滤残留固体,干燥后称量,质量增加了2.4g。
⑴求溶解的铜的质量。
⑵求原硫酸溶液的物质的量浓度。
答案
⑴根据题意发生如下反应:
①Cu+2H2SO4(浓) CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
②Fe+H2SO4===FeSO4+H2↑ ③Fe+CuSO4===FeSO4+Cu
由于n(H2)=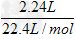 =0.1 mol
=0.1 mol
所以反应②中溶解的Fe为0.1 mol,固体减少,质量为5.6 g,那么在反应③中固体增加质量为5.6+2.4=8 g
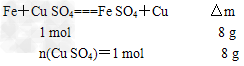
因此,溶解的Cu为1 mol,即m(Cu)=64 g
⑵硫酸的总物质的量为n(H2SO4)=2 mol+0.1 mol=2.1 mol
∴c(H2SO4)=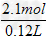 =17.5 mol/L
=17.5 mol/L
