图1是A、B、C三种物质的溶解度曲线,回答下列问题:
(1)Q点表示______.
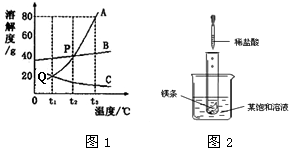
(2)P点表示______.
(3)t2℃时A、B、C三种物质溶解度由小到大的顺序______
(4)分别将A、B和C的饱和溶液从t3℃降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是______.
(5)要从A物质的饱和溶液中得到A物质,可用的方法是______,要从B物质的饱和溶液中得到B物质,可用的方法是______.
(6)t2℃时,______和______的饱和溶液中溶质的质量分数相等
(7)t3℃时,向100g水中加入90gA物质,充分溶解后,所得溶液是______溶液(填“饱和”或“不饱和”),所得溶液中溶质的质量分数
______
(8)将t2℃时的等质量三种物质的饱和溶液分别降到0℃时,析出溶质最多的是______,无溶质析出的是______
(9)如图2所示,当往试管中加入5mL稀盐酸时,试管内立刻产生大量气泡,同时放热使烧杯中饱和溶液变浑浊(不考虑水分蒸发).请判断:该饱和溶液中的溶质是A、B和C中的______.
(1)Q点表示:t1℃时A、C的溶解度相同;
(2)P点表示:t2℃时A、B的溶解度相同;
(3)t2℃时A、B、C三种物质溶解度由小到大的顺序:C<B=A;
(4)A物质的溶解度受温度影响最大.等质量的三种饱和溶液从t3℃降温到t1℃时,A析出的溶质最多,B其次,而C由于溶解度增大而无晶体析出.而降低到t1℃时,由于溶解度是B>A,此时虽然C的溶解度大,但由于不是饱和溶液,所以其溶解的物质还是和先前的t3℃相同,也就是此时计算还是要考虑该温度下的溶解度,所以在t1℃,溶解物质的关系就是C<A<B,根据饱和时质量分数的计算式
×100%=溶解度 溶解度+100g
×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是:B>A>C;1 1+ 100g 溶解度
(5)A的溶解度受温度影响最大,故要从A物质的饱和溶液中得到A物质,可用降温结晶或冷却热饱和溶液的方法;B的溶解度受温度影响不大,故要从B物质的饱和溶液中得到B物质,可用蒸发溶剂的方法;
(6)t2℃时A、B的溶解度相同,故其饱和溶液中溶质的质量分数相等;
(7)由溶解度曲线图可知:t3℃时A的溶解度是80g,所以向100g水中加入90gA物质,充分溶解后最多溶解80g,所得溶液是饱和溶液;溶质的质量分数是:
×100%≈44.4%;80g 180g
(8)将t2℃时的等质量三种物质的饱和溶液分别降到0℃时,A的溶解度变化差异最大,故析出溶质最多;C的溶解度随温度降低而减小,故无溶质析出;
(9)化学反应放热使烧杯中饱和溶液变浑浊,说明有溶质析出,该物质的溶解度随温度的升高而减小,是C物质;
故答案为:(1)t1℃时A、C的溶解度相同;
(2)t2℃时A、B的溶解度相同;
(3)C<B=A;
(4)B>A>C;
(5)降温结晶或冷却热饱和溶液;蒸发溶剂;
(6)A;B;
(7)饱和;44.4%;
(8)A;C;
(9)C.
