Ⅰ.化合物A、B是中学常见的物质,其阴阳离子可从下表中选择阳离子 K+ Na+ Fe2+ Ba2+ NH4+ 阴离子 OH- NO3- I- HSO3- AlO2- HSO4-
(1)若A、B的水溶液均为无色,B的水溶液呈碱性,且混合后只产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为___________;
②A、B溶液混合后加热呈中性反应的离子方程式为_____________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A为__________;B为___________;
②经分析上述过程中溶液变黄的原因可能是有两种:Ⅰ______________ Ⅱ ___________;
③请用一简易方法证明上述溶液变黄的原因 ______________;
Ⅱ.已知溶液中,还原性:HSO3->I-,氧化性:IO3->I2>SO42-。在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,据图回答下列问题:
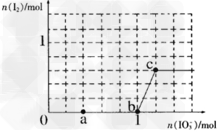
(1)a点处的氧化产物是_____________(用离子符号填写,下同), a点对应的离子方程式为______________。
(2)当n(I2)达最大时,n(IO3-)对应的最小值为__________mol,此时反应的离子方程式是_________________。
Ⅰ.(1)① Ba(OH)2
②H+ +SO42-+ NH4+ + Ba2+ +2OH- ===BaSO4↓+ NH3↑+ 2H2O
(2)①FeI2 ; NaNO3
② Ⅰ 仅有Iˉ被氧化成I2使溶液呈黄色; Ⅱ I-、Fe2+均被氧化使溶液呈黄色
③ 取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可
Ⅱ. (1)SO42- , 3HSO3-+ IO3-=== 3SO42- + I-+ 3 H+
(2)1.2mol,5Iˉ+ IO3-+ 6 H+ === 3I2 + 3H2O
