(8分).处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g)。发生反应为:

(1)已知:CO(g)+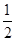 O2(g)=CO2(g) △H=-283.0kJ·mol—1
O2(g)=CO2(g) △H=-283.0kJ·mol—1
S(g)+O2(g)=SO2(g) △H=" -" 296.0 kJ·mol—1
试写出利用上述方法处理烟道气的热化学方程式
(2)在容积为2L的密闭容器中,充入4molCO和2molSO2,在一定条件下发生反应2CO(g)+SO2(g) S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则:
S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则:
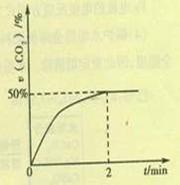
①0-2min内的平均反应速率v(CO)= 。
②该温度下,上述反应的平衡常数K= (填数值)。
③2min后改变下列条件能使上述反应的反应速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度 c.及时分离出二氧化碳 d.增加SO2的浓度
(1)2CO(g)+SO2(g) S(g)+2CO2(g) △H=-270kJ·mol-1
S(g)+2CO2(g) △H=-270kJ·mol-1
(2) ①0.75 mol·L—1 ·min—1②27 ③d
(1)①×2-②可得,2CO(g)+SO2(g) S(g)+2CO2(g) △H=-270kJ·mol-1
S(g)+2CO2(g) △H=-270kJ·mol-1
(2)由图像可得出,2min时,CO2在混合气体中的物质的量分数为50%,故:
反应为:2CO(g)+SO2(g) S(g)+2CO2(g)
S(g)+2CO2(g)
开始n: 4 2 0 0
△n: 2x x x 2x
2min n: 4—2x 2—x x 2x
即: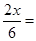 50%,x=1.5mol (可逆反应两边气体系数相等)
50%,x=1.5mol (可逆反应两边气体系数相等)
①v(CO)=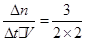 =0.75 mol·L—1 ·min—1
=0.75 mol·L—1 ·min—1
②K=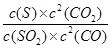 =
=
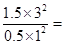 27
27
③催化剂不能影响平衡移动,排除a;升温平衡左移,排除b;分离出CO2,反应速率将减小,减除;增加SO2的浓度平衡正向移动,反应速率加快,故选择d
