化学能的转化在现实生活中得到了广泛的利用。回答以下问题:
(Ⅰ)(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1=" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2=" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

(Ⅱ)下图为相互串联的甲乙两个电解池:
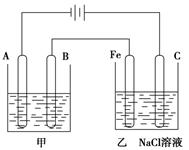
请回答:
(1)甲池若为用电解原理精炼铜的装置,则:
A极是 极,材料是 ,电极反应为 ,
B极是 极,材料是 ,电极反应为 ,
电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积
_________________。
(4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
__ _____。
(Ⅰ)(1)CH4(g)+2O2(g)==== CO2(g)+ 2H2O(g) ΔH =" —880" kJ/mol
(2)+260 kJ/mol
(3)NO2(g)+CO(g)="===" CO2(g)+NO(g) ΔH =" —234" kJ/mol
(Ⅱ)(1)阴 纯铜 Cu2++2e-=Cu 阳 粗铜 Cu-2e-=Cu2+ CuSO4溶液
(2)红
(3)4.48 L
(4)1mol/L
(Ⅰ)(1)由题目信息可折算出1mol甲烷完全燃烧生成稳定的氧化物时所放出的热量为16×55=880kJ,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)==== CO2(g)+ 2H2O(g) ΔH =" —880" kJ/mol
(2)根据所给两热化学方程式可得到:
①ZnO(s)=Zn(s)+1/2O2(g) ΔH1=" +351" kJ/mol
②Hg(l)+1/2O2(g)=HgO(s) ΔH2= —91kJ/mol
①+②得到:ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=+260 kJ/mol
(3)由图可知,该反应为放热反应,△H3=134—368=—234 kJ/mol,故热化学方程式为:
NO2(g)+CO(g)="===" CO2(g)+NO(g) ΔH =" —234" kJ/mol
II(1)甲池若为精炼铜的装置,电解质溶液应为铜盐,经常用硫酸铜溶液,则:
粗铜做阳极,即与外电源的正极相连的B极:Cu-2e-=Cu2+
纯铜做阴极,即A极:Cu2++2e-=Cu
(2)乙池中铁极做为电解池的阴极:2H2O+2e-=H2↑+2OH-,溶液呈碱性,滴入酚酞后呈红色
(3)甲槽阴极析出铜增重,则乙槽阳极放出氯气:2Cl-2e-=Cl2↑,由关系式Cu~2e-~Cl2↑,可知氯气在标准状况下的体积为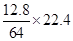 =4.48L
=4.48L
(4)由关系式2OH-~Cl2↑可知,c(OH-)=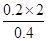 =1mol/L
=1mol/L
