已知H2S和 SO2 反应生成 S和 H2O
①写出反应的化学方程式并标出电子转移的方向和数目______
②上述反应中被氧化的硫原子和被还原的硫原子的物质的量之比为______
③现有H2S和 SO2混合气体1mol,充分反应后得到的产物中,若还原产物比氧化产物少1.6g,则反应中转移电子数为______NA,原混合物中H2S和 SO2的物质的量可能各是多少______.
①H2S+SO2→S+2H2O的反应中,硫化氢中硫元素失电子由-2价→0价,二氧化硫中硫元素由+4价→0价,所以得失电子的最小公倍数是4,则硫化氢的计量数是2,二氧化硫的计量数是1,然后根据原子守恒配平方程式得2H2S+SO2=3S+2H2O,该反应的化学方程式及电子转移的方向和数目为:
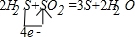
,
故答案为:
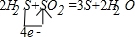
;
②该反应中硫化氢是还原剂,二氧化硫是氧化剂,且硫化氢和二氧化硫分子中都含有一个硫原子,根据方程式知,被氧化的硫原子和被还原的硫原子的物质的量之比为2:1,故答案为:2:1;
③设转移电子数为x,
2H2S+SO2=3S+2H2O 转移电子 氧化产物和还原产物的差
4NA 32g
x 1.6g
x=
=0.2NA,1.6g×4NA 32g
假设硫化氢完全反应,则硫化氢的物质的量为y,
2H2S+SO2=3S+2H2O 氧化产物和还原产物的差
2mol 32g
y 1.6g
y=
=0.1mol,则二氧化硫的物质的量=(1-0.1)mol=0.9mol;2mol×1.6g 32g
假设二氧化硫完全反应,则二氧化硫的物质的量为z,
2H2S+SO2=3S+2H2O 氧化产物和还原产物的差
1mol 32g
z 1.6g
z=
=0.05mol,则硫化氢的物质的量=(1-0.05)mol=0.95mol,1mol×1.6g 32g
故答案为:0.2;
或H2S 0.1mol SO2 0.9mol
.H2S 0.95mol SO2 0.05mol
