利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为 。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
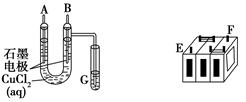
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为: ,充电时该极与外加电源的 极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是 ;要想CuSO4溶液恢复原样,需加入的物质是 ,质量为
(Ⅰ) (1)小于 由于该反应是可逆反应,反应物无法全部转化为生成物 不变
(2)391
(3)N2H4(g)+NO2(g)==="3/2" N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1
(Ⅱ)(1)气泡 2Cl――2e-====Cl2↑
(2)Pb-2e-+SO42-=PbSO4 负极
(3) 0.1 mol CuO 8g
0.1 mol CuO 8g
(Ⅰ)(1)合成氨反应为可逆反应,不可能进行到底,故在实际生产中,1 mol N2(g)和3 mol H2(g)不可能生成2molNH3,放出的热量也必定小于92kJ;
ΔH只与反应物的系数成正比,而与是否使用催化剂没有关系
(2)ΔH=反应物的键能之和—生成物的键能之和=946+3×436—6×N—H键键能=-92 kJ·mol-1,得N—H键键能为391 kJ·mol-1
(3)由①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
根据盖斯定律可知②—①/2得:N2H4(g)+NO2(g)==="3/2" N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1
(II)(1)由图示可知,B极生成氯气:2Cl――2e-====Cl2↑,失电子,发生氧化反应,连接的是外电源的正极,即F极为正极,E极为电池负极
(2)对于铅蓄电池来说,放电时,E极为负极:Pb-2e-+SO42-=PbSO4,充电时与外电源的负极相连
(3)电解Cu(NO3)2 溶液,其电解方程式为
由关系式PbO2~2 e-~Cu~1/2O2↑~CuO可知,当有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是0.1mol;
要想CuSO4溶液恢复原样,需加入的物质是CuO,其质量为0.1×80=8g
