问题
问答题
将5.05gKNO3加到含FeSO40.33mo1的稀硫酸溶液中,充分反应后再通入0.09mo1C12,恰好将剩余的Fe2+全部氧化,通过计算确定(要计算过程):
(1)写出氯气发生反应的离子方程式标出电子转移的方向和数目;
(2)求KNO3被还原后氮的化合价.
答案
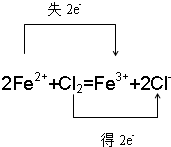
(1)氯气与Fe2+反应生成Fe3+与Cl-,反应离子方程式为2Fe2++Cl2=Fe3++2Cl-,标出电子转移的方向和数目为
.
故答案为:

.
(2)5.05gKNO3的物质的量为
=0.05mol,由2Fe2++Cl2=Fe3++2Cl-可知,0.09mo1C12能氧化Fe2+为2×0.09mol=0.18mol,所以NO3-氧化的Fe2+为0.33mol-0.18mol=0.15mol,令N元素在还原产物中的化合价为x,根据电子转移有0.05mol×(5-x)=0.15mol×(3-2),解得x=2.5.05g 101g/mol
答:KNO3被还原后氮的化合价为+2.