向100 ml浓硫酸中加入64 g铜片,加热一段时间后,至不再反应为止,请回答下列问题:
(1)写出反应的化学方程式: 。
(2)若反应中有1.5 mol电子转移,被还原的硫酸为 mol,标准状况下生成的SO2气体体积为 L。
(3)将(2)反应后液体过滤,加水稀释滤液至500 ml,加足量Zn粉,经足够长的时间后,放出标准状况下6.72L H2,则反应的Zn的质量为 g,原浓硫酸的物质的量浓度为
mol·L-1。
(1)Cu+2H2SO4 (浓)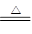 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)0.75 mol; 16.8 L (3)19.5 g; 18 mol·L-1
考查根据方程式进行的有关计算。
(1)在加热的条件下,浓硫酸能和铜反应,方程式为Cu+2H2SO4 (浓)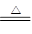 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)在反应硫酸中硫的化合价从+6价降低到+4价,转移2个电子,所以若反应中有1.5 mol电子转移,被还原的硫酸为1.5mol÷2=0.75 mol。生成的SO2是0.75 mol,其标准状况下的体积是0.75 mol×22.4L=16.8 L。同时生成硫酸铜是0.75mol,参加反应的硫酸是1.5mol。
(3)稀释后是稀硫酸,和锌反应生成氢气,方程式为Zn+H2SO4=ZnSO4+H2↑。根据题意可知,氢气是6.72L÷22.4L/mol=0.3mol,所以参加反应的锌也是0.3mol。但锌也和溶液中的硫酸铜反应,方程式为Zn+CuSO4=ZnSO4+Cu。根据(2)可知消耗锌是0.75mol,所以消耗锌的总质量是1.05mol×65g/mol=68.25g,参加反应的硫酸是0.3mol。因此根据(2)可知原溶液中硫酸是1.5mol+0.3mol=1.8mol,所以硫酸的浓度是1.8mol÷0.1L=18mol/L。
