问题
计算题
(6分)将32g铜与250mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2L。试计算
(1)被还原的HNO3的物质的量 mol
(2)若反应后体积不变,溶液的物质的量浓度为
(3)NO的体积为
答案
(1)0.5 ; (2)2mol•L‾1; (3)5.6L
硝酸属于氧化性酸可将铜氧化成硝酸铜,而自身被还原成NO或NO2。根据N原子守恒可知被还原的HNO3的物质的量就是还原产物NO和NO2的物质的量之和,即为
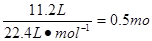 ;由铜原子守恒可知氧化产物硝酸铜的物质的量为
;由铜原子守恒可知氧化产物硝酸铜的物质的量为
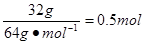 ,因此溶液的物质的量浓度为
,因此溶液的物质的量浓度为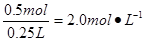 ;若设NO和NO2的物质的量分别为X和Y,则由得失电子守恒可知①0.5mol×2=3X+Y,又因为②X+Y=0.5mol,由①②可计算出X和Y分别为0.25mol和0.25mol,所以在标准状况下NO的体积为0.25mol×22.4L•mol-1=5.6L。
;若设NO和NO2的物质的量分别为X和Y,则由得失电子守恒可知①0.5mol×2=3X+Y,又因为②X+Y=0.5mol,由①②可计算出X和Y分别为0.25mol和0.25mol,所以在标准状况下NO的体积为0.25mol×22.4L•mol-1=5.6L。
