CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) △H3= +131.3kJ·mol-1
则反应CO(g)+H2(g) +O2(g)===H2O(g)+CO2(g)的△H=__________。标准状况下的煤炭气(CO、H2)
336L与氧气反应生成CO2和H2O,反应过程中转移_________mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-===3CO2+H2O;则该电池的正极反应式是:_____________。
(3)密闭容器中充有1 mol CO与2mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
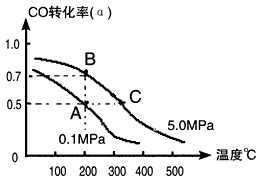
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数
K=________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tC______tA(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是________________。(写出两点即可)
(1)-524.8kJ/mol;30
(2)O2+4e-+2CO2 =2CO32-
(3)①100;小于;②小于;③降温、加压、将甲醇从混合体系中分离出来(答出两点即可)
