(12分)甲醇作为新型汽车动力燃料,工业上可由CO和H2合成。该反应的热化学方程式: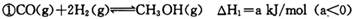
该反应的原料CO和H2本身可作为燃料,它们的热化学方程式为: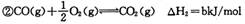
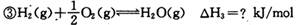
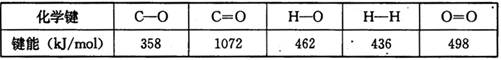
某些化学键的键能数据如下表
请回答下列问题:
(1)反应③中的ΔH3=________kJ/mol
(2) CH3OH燃烧生成CO2(g)和H2O(g)的热化学方程式为
 ,该反应的焓变
,该反应的焓变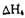 =________kJ/mol (用含a、b的式子表示);
=________kJ/mol (用含a、b的式子表示);
(3) 若降低温度,反应①的化学平衡常数K值将________ (填“增大”、“减小”或“不变”);
(4) 甲醇一空气电池是一种髙效、低污染质子交换腆燃料电池,电池总反应为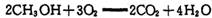 。甲醉在催化剂作用下提供质子和电子。右图为该电池的示意图,则电极d上发生的电极反应式为________________。
。甲醉在催化剂作用下提供质子和电子。右图为该电池的示意图,则电极d上发生的电极反应式为________________。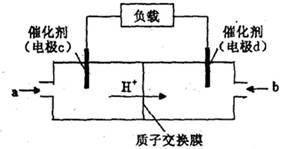
(1)- 239;(2)b-a-478;(3) 增大;(4)O2+4e-+4H+=2H2O。
本题考查化学反应热的计算、化学平衡常数比较和电化学知识。
(1)反应热可根据反应和生成物的键能进行计算,ΔH3=反应键能之和- 生成物键能之和= -436 kJ/mol +(1/2)498 kJ/mol-2×462 kJ/mol="-" 239kJ/mol;
(2)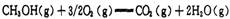 可由②-①-2×③得ΔH4=ΔH2-ΔH1-2ΔH3="(b-a-478)" kJ/mol;
可由②-①-2×③得ΔH4=ΔH2-ΔH1-2ΔH3="(b-a-478)" kJ/mol;
(3) 反应①正反应是放热反应,若降低温度,平衡向正反应方向移动,平衡常数K值将增大;
(4) 从该电池的示意图H+的移动方向可以看出,电极d是该电池的正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O。
