(7分)(1)用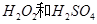 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: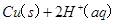 ====
==== △H=+64kJ/mol
△H=+64kJ/mol
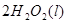 ====
====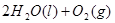 △H= -196kJ/mol
△H= -196kJ/mol
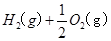 ="==="
="===" 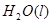 △H= -286kJ/mol
△H= -286kJ/mol
在 溶液中
溶液中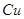 与
与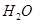 反应生成
反应生成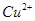 和
和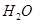 的热化学方程式为 。
的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅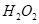 和3.0 mol/L的
和3.0 mol/L的 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
| 铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 | |
(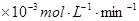 ) ) | ||||||||
(3)在提纯后的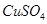 溶液中加入一定量的
溶液中加入一定量的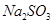 和
和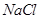 溶液,加热,生成
溶液,加热,生成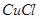 沉淀。制备
沉淀。制备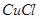 的离子方程式是 。
的离子方程式是 。
(1) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-320.KJ.mol-1(3分)
(2)H2O2分解速率加快 (2分)
(3)2Cu2++SO32-+2Cl-+H2O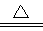 2CuCl↓+SO42-+2H+(2分)
2CuCl↓+SO42-+2H+(2分)
(1)考查盖斯定律的应用。由
① ====
====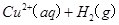 △H=+64kJ/mol;
△H=+64kJ/mol;
②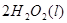 ====
====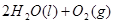 △H= -196kJ/mol;
△H= -196kJ/mol;
③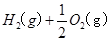 ="==="
="===" 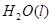 △H= -286kJ/mol知,①×2+②+③×
△H= -286kJ/mol知,①×2+②+③×
+ |
(3)CuSO4生成CuCl说明Cu的化合价降低了,即CuSO4作氧化剂,得到1个电子,Na2SO3作还原剂失去2个电子,其氧化产物是Na2SO4,所以反应的方程式为:2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+。
2CuCl↓+SO42-+2H+。
