(13分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数K=_________,该反应为 (填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
。
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
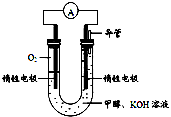
①该电池负极的电极反应为: 。
②该电池工作时,溶液中的OH-向______极移动。
(1)5 C + 4KMnO4 + 6 H2SO4 = 5CO2↑+ 4MnSO4 + 2K2SO4+ 6H2O (2分)
⑵①0.13mol/(L·min) (2分)
②0.17(2分) 放(2分)
(3)CH3OH(l)+O2(g)=CO(g)+2H2O(g)ΔH=-709.6KJ/mol(2分)(答案错误)
(4)①CH3OH+8OH— —6e-=CO32-+6 H2O(2分)
②负(1分)
本题为理论考查题,考查到氧化还原理论(配平)、化学平衡理论、热化学以及电化学相关知识和计算。(1)关键搞清楚化合价的变化情况:C从0→+4,升高4价,Mn从+7→+2,降低5价,取最小公倍数20进行配平。(2)v(CO2)= v(CO)==0.13 mol/(L·min),
| 第一组 | 第二组 | |||||||
CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) | CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) | |||||||
| 始态mol | 4.0 | 2.0 | 0 | 0 | 2.0 | 1.0 | 0 | 0 |
| 反应mol | 1.6 | 1.6 | 1.6 | 1.6 | 0.4 | 0.4 | 0.4 | 0.4 |
| 终态mol | 2.4 | 0.4 | 1.6 | 1.6 | 1.6 | 0.6 | 0.4 | 0.4 |
| 浓度 mol/L | 1.2 | 0.2 | 0.8 | 0.8 | 0.8 | 0.3 | 0.2 | 0.2 |
