I:(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。请写出氢气燃烧的热化学方程式 。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
Ⅱ:在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,如图所示:
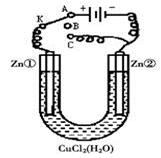
(1)如果把电键K接A,这一装置形成 装置,Zn①极是_____极,其电极反应式是_______________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成________装置,Zn②极是_______极,其电极反应式是____________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于 ,Zn①极发生的腐蚀主要属于 。
I:(1)2H2(g)+O2(g)= 2H2O(l) △H=-572KJ•mol-1
(2)632
II、(1)电解池 阳极 Zn -2e- =Zn2+
(2)原电池 正极 Cu2+ +2e- = Cu
(3)电化学腐蚀 化学腐蚀
I:(1)考查热化学方程式的书写。根据题意不难写出氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2H2O(l) △H=-572KJ•mol-1。(2)N2和O2反应的化学方程式是N2+O2=2NO。在化学反应中断键需要吸热,成键需要放热,因为反应吸热,所以根据题意可得出以下关系式:946+498-2x=180,解得x=632。即NO分子中氮氧键的键能是632KJ•mol-1,所以1molNO分子中的化学键形成时可释放632KJ的能量。
Ⅱ:(1)把电键K接A,则线路中有外加电源,故是电解池。Zn①极与电源的正极相连,作阳极,其电极反应式是Zn -2e-=Zn2+。而阴极反应式是Cu2+ +2e-=Cu,生成的铜附着在锌表面。(2)反应进行5min后,转换电键K到C,此时由于Zn②表面有铜附着,所以此时应构成原电池,Zn②极是正极,其电极反应式是Cu2+ +2e-=Cu。(3)进行2min后,再转换电键K到B,此时形成了断路,但由于Zn②极上仍然有金属铜附着,所以会发生电化学腐蚀,而Zn①极是纯锌,则发生化学腐蚀。
