如图一为NaCl、KNO3的溶解度曲线.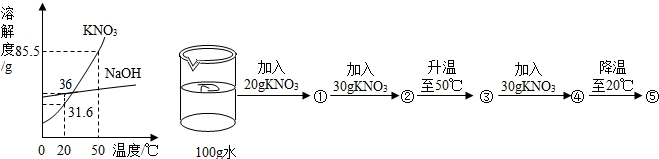
(1)20℃时,NaCl的溶解度是______.
(2)20℃时,将20gNaCl固体投入到50g水中,得到的是NaCl的______(填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量分数是______(保留到0.1%).
(3)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、蒸发浓缩、______,然后过滤、洗涤、干燥.
(4)某同学在20℃时进行了如图二实验,得到相应的溶液①~⑤,下列说法正确的是______
A.向④加入4.5gKNO3即可达到饱和B.②③⑤中溶质的质量分数相等
C.①③④均为KNO3的不饱和溶液D.④→⑤可析出53.9gKNO3晶体.
(1)由溶解度曲线图可知20℃时,NaCl的溶解度是36g;
(2)20℃时,NaCl的溶解度是36g,即该温度下,100g水中最多溶解36g氯化钠,所以50g水中最多溶解18g,所以20℃时,将20gNaCl固体投入到50g水中,得到的是NaCl的饱和溶液,此时溶液中溶质的质量分数是:
×100%=26.5%;18g 18g+50g
(3)硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,所以利用降温结晶方法进行分离,具体方法是:加水溶解、蒸发浓缩,降温结晶,过滤、洗涤、干燥.
(4)在20℃时进行了如下实验,则:①已知在20℃时硝酸钾的溶解度为31.6克,则20克硝酸钾全部溶解;②又加入的30克硝酸钾只能溶解11.6克;③加热知50℃时,50克硝酸钾全部溶解;④再加30克硝酸钾,全部溶解,因为在50℃时,其溶解度为85.5克;⑤降温至20℃时,由晶体析出,只能溶解31.6克
A、由以上知,④中的溶质为80g,在50℃时,其硝酸钾溶解度为85.5克,所以应在加5.5克,达到饱和,故A错误;
B、②中溶质为31.6g,③中的溶质是50g,⑤中的溶质是31.6g,所以②③⑤中溶质的质量分数不相等,故B错误;
C、由以上分析知,①③④均为不饱和溶液;故C正确;
D、④→⑤可析出的晶体为:80-31.6=48.4g,故D错误;
故选C.
故答案为:(1)36.0g;(2)饱和;26.5%;(3)降温结晶;(4)C.




