如图1是A.B.C三种物质的溶解度曲线,据图回答:
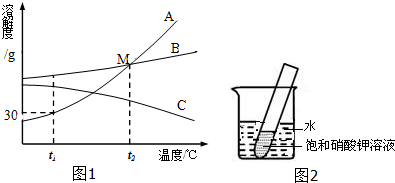
(1)t1℃时A.B.C三种物质的溶解度由大到小的顺序是______(填写序号).
(2)M点表示的意义是______.
(3)t1℃时30gA物质加入到50g水中不断搅拌形成的溶液质量是______g.
(4)将t1℃时A.B.C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大小关系是______(填写序号)
(5)当A中混有少量的B时,要提纯A应采用的方法是:______.(填“降温结晶”或“蒸发结晶”)
(6)如图2所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的______(填字母序号)
A.氢氧化钠固体 B.生石灰固体 C.冰块 D.硝酸铵固体E.浓硫酸.
(1)t1℃时A.B.C三种物质的溶解度由大到小的顺序是B>C>A;
(2)M点是t2℃时AB的溶解度曲线的交点,表示该温度下两物质的溶解度相等;
(3)t1℃时A的溶解度是30g,所以30gA物质加入到50g水中不断搅拌最多溶解15g,形成的溶液质量是 65g;
(4)AB的溶解度随温度升高而增大,C的溶解度随温度升高而减小,所以将t1℃时A.B.C三种物质饱和溶液的温度升高到t2℃时,AB变为不饱和溶液,溶质、溶剂质量不变,溶质的质量不变与升温前相等,C析出晶体,溶质的质量分数减小;据饱和溶液中溶质的质量分数的计算式
×100%可知:溶解度越大质量分数也就越大,而t1℃时B的溶解度大于t2℃时C的溶解度大于t1℃时A的溶解度,所以三种溶液的溶质质量分数由大小关系是B>C>A;溶解度 溶解度+100g
(5)由图可知:A的溶解度受温度影响比B大,所以当A中混有少量的B时,要提纯A应采用降温结晶的方法;
(6)如图2所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,而硝酸钾的溶解度随温度升高而增大,通过现象可知溶液的温度降低,导致硝酸钾的溶解度减小而析出,而冰、硝酸铵溶于水可使溶液的温度降低,符合要求;
故答案为:(1)B>C>A;
(2)t2℃时AB的溶解度相等;
(3)65;
(4)B>C>A;
(5)降温结晶;
(6)CD.

 N2O4(g) △H<0,升高温度该反应平衡常数增大
N2O4(g) △H<0,升高温度该反应平衡常数增大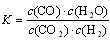 的反应,化学方程式为CO2+H2
的反应,化学方程式为CO2+H2 CO+H2O
CO+H2O