问题
填空题
(10分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物对应的水化物是_______(填化学式);
(2)物质E中所包含的化学键有________,写出C、D两元素形成的化合物C2D的电子式_________;
(3)在同主族氢化物的递变性质中,A的氢化物沸点反常,这可以用 解释。
A.共价键 B.离子键 C.氢键 D.范德华力
(4)与C同主族且处于第七周期的元素的原子序数是 .
答案
(1)HNO3 (2)离子键共价键; Na2S电子式略(3)C (4)87
依题意知A、B、C、D分别为N、O、Na、S .E为过氧化钠
(1)HNO3 (2) .E为过氧化钠,含有离子键和共价键; Na2S电子式 :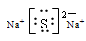
(3)氨分子间有氢键,选C (4)11+8+18+18+32=87
