已知:N2 (g) +3H2(g)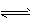 2NH3(g) △H = -92.4 kJ . mol-1。
2NH3(g) △H = -92.4 kJ . mol-1。
(1)在500℃、2.02×107Pa和铁催化条件下,于2L密闭容器中充入1 mol N2和3 mol H2,10 min 时达到平衡,有0.2 mol NH3生成,则10 min内用氮气表示的该反应的平均速率v(N2)为 ___,H2的转化率为___。
(2)充分反应后,放出的热量___(填“<”、“>”或“=”)92.4 kJ,理由是___。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有__。
A.降低温度
B.不断补充氮气
C.恒容下充入He来增大压强
D.升高温度
E.原料气不断循环
F.及时移出氨
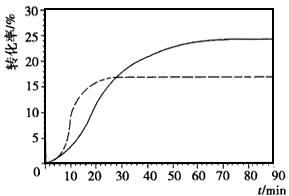
(4)氨催化氧化制NO是在热的铂铑合金催化作用下进行的,反应为4NH3(g)+5O2(g) 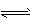 4NO(g)+6H2O(g),反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为 ____,当升高温度时,K值___(填“增大”、“减小”或“不变”)。NH3的转化率在温度T1下随反应时间(t)的变化如图所示。其他条件不变,仅改变温度为T2(T2大于T1),在框图中用虚线画出温度T2下NH3的转化率随反应时间变化的预期结果示意图。
4NO(g)+6H2O(g),反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为 ____,当升高温度时,K值___(填“增大”、“减小”或“不变”)。NH3的转化率在温度T1下随反应时间(t)的变化如图所示。其他条件不变,仅改变温度为T2(T2大于T1),在框图中用虚线画出温度T2下NH3的转化率随反应时间变化的预期结果示意图。
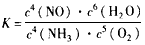
(1)0.005 mol·L-1·min-1;10%
(2)<;在101 kPa和298 K条件下,1 mol氮气和3 mol 氢气完全反应生成2 mol氨气,放出92.4 kJ热量,该反应为可逆反应,反应物不能全部转化为生成物;又因为反应温度为 500℃,所以放出的热量小于92.4 kJ
(3)BEF
(4)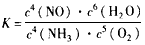 ;减小;
;减小;