问题
填空题
(8分)A、B、C、D为短周期的主族元素,它们的原子序数依次增大。A和C的原子最外层电子数相等;C+阳离子与Ne原子的电子层结构相同;B、D同主族,B元素原子的最外层电子数是内层电子数的3倍;A与B能形成A2B及A2B2两种化合物,其在常温常压下均呈液态。请回答下列问题:
(1)C2B2中含有的化学键是 。
(2)化合物A2B2的电子式是 。
(3)A、B、C、D离子半径由大到小的顺序为(用离子符号表示) 。
(4)用电子式表示化合物A2B的形成过程: 。
答案
(1)离子键、非极性键(2分) (2)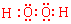 (2分)
(2分)
(3)S2->O2->Na+>H+(2分) (4)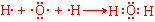 (2分)
(2分)
考查原子核外电子的排布规律及元素周期律的应用。C+阳离子与Ne原子的电子层结构相同,所以C是Na。B元素原子的最外层电子数是内层电子数的3倍,则B是O。B、D同主族,所以D是S。根据A和O形成的化合物的性质可判断A应该是H。
(1)过氧化钠属于离子化合物,含有离子键和非极性键。
(2)H2O2是共价化合物,含有极性键和非极性键,电子式为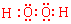 。
。
(3)对于核外电子排布相同的微粒,其微粒半径随原子序数的递增而减小,所以大小顺序为S2->O2->Na+>H+。
(4)H2O是极性键形成的共价化合物,所以形成构成为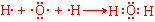 。
。
