问题
填空题
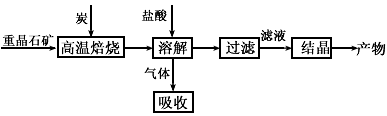
工业上制备BaCl2的工艺流程图如下图某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。
查表得:
BaSO4(s)+4C(s) 4CO(g)+ BaS(s) △H1=+571.2kJ ·mol-1 ①
4CO(g)+ BaS(s) △H1=+571.2kJ ·mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) △H2 =+ 226. 2kJ·mol-1 ②
2CO2(g)+BaS(s) △H2 =+ 226. 2kJ·mol-1 ②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时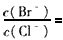 ____________. [ Ksp ( AgBr) = 5.4×10-13 ,Ksp ( AgCl) = 2. 0×10 -10 ]
____________. [ Ksp ( AgBr) = 5.4×10-13 ,Ksp ( AgCl) = 2. 0×10 -10 ]
(3)反应C(s) +CO2(g) 2CO( g)的△H=__________kJ·mol-1。
2CO( g)的△H=__________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是_________。
答案
(1)S2- +H2O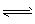 HS- +OH- ;HS- +H2O
HS- +OH- ;HS- +H2O H2S+ OH -(可不写)
H2S+ OH -(可不写)
(2)2.7×10-3
(3) +172.5
(4)使BaSO4得到充分的还原(或提高BaS的产量),①② 为吸热反应,炭和氧气反应放热维持反应所需的高温